現在、心血管系のリモデリングとTRPタンパク質、骨格筋肥大シグナルと低酸素、血管内皮前駆細胞と血管再生、さらに、各種病態におけるイオンチャネルの役割につき研究している。
心血管系のリモデリングとTRPタンパク質
心臓線維芽細胞は様々な刺激に対して、筋芽細胞への分化、遊走、増殖、炎症性サイトカインや成長因子の分泌、細胞外基質の生成など心臓における重要な役割を演じていることはよく知られている。さらに、多くの病態において、心筋の線維化が心筋における病理組織学的リモデリングに重要な役割を担っている。一方、TRP蛋白には,主にTRPC, TRPV, TRPMに分類され,心筋/血管内皮細胞など様々な細胞において,細胞内Ca動員機構、生体反応の上で重要な役割を演じているとともに、各種病態に関与していることが報告されている。これまで、TRPC3, 6 は、心筋細胞において、calcineurin及びNFATを介して心筋肥大に関与することが報告されている。また、心臓線維芽細胞においては、TRPM7が心房細動における心筋線維化に関与していることが報告されている。しかし、未だ詳細な報告はなく、ヒト心臓線維芽細胞のTRP蛋白の薬理学的・分子生物学的検討を行っている。又、糖尿病では、心筋症を発症することもあり、これにも心臓線維芽細胞の関与が示唆されている。我々は、高血糖と関連の深い代謝物であるmethylglyoxalがヒト心臓線維芽細胞の機能に重要な役割を演じていることを見出したので (Oguri et al.,2014)、この点からも検討を加えている。ヒト心臓線維芽細胞ではSOC、DGにて活性化されるTRPC channelが存在し、特にangiotensin IIによる細胞外からのCa流入には、TRPC6が重要な役割を演じていると考えられた (Ikeda et al., 2013)。さらに、TGFβは、ヒト心臓線維芽細胞の増殖をきたすが、これには、reverse modeのNa/Ca exchanger、TRPCの関与が考えられた。さらに、高血糖と関連の深い代謝物であるmethylglyoxalも、ヒト心臓線維芽細胞に対して作用し、糖尿病などさまざまな病態での機能に重要な役割を持っていると思われ、その機序の解明を目指している。
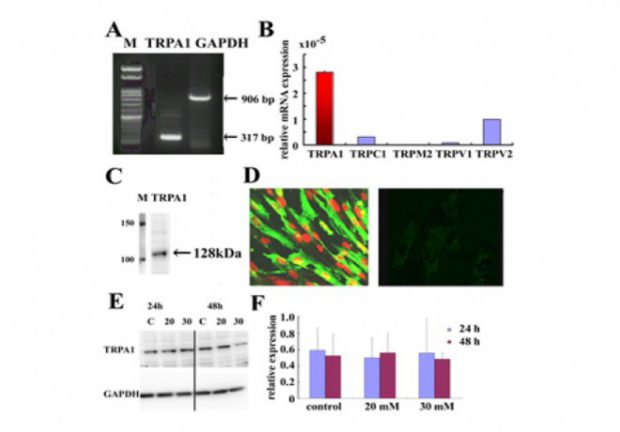
図1 ヒト心臓繊維芽細胞に発現するTRPA1チャネル (Oguri et al., 2014)
脂肪機能とTRP蛋白質
肥満、メタボリック症候群は、生活習慣病、心血管系疾患において重要な役割を演じているのはよく知られている。とくに、心疾患の死亡率と密接に関連し、その対策は極めて重要である。我々は、温熱刺激に注目して、基礎的研究を実施している
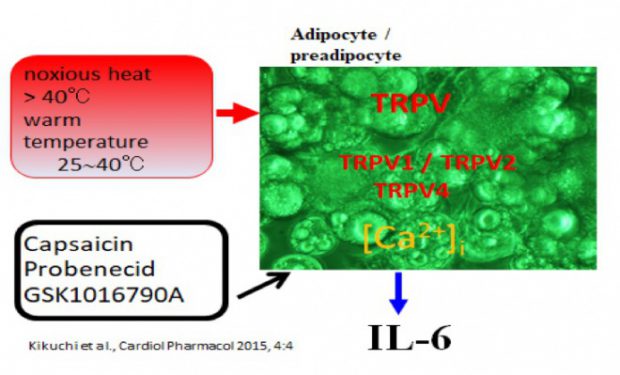
図2 脂肪細胞の温熱刺激によるIL-6分泌におけるTRPVチャネルの関与
骨格筋肥大シグナルと低酸素・温熱刺激
骨格筋細胞における筋肥大シグナルに及ぼす低酸素・温熱刺激などの影響につき検討している。(Obi et al., 2017)
各種病態におけるイオンチャネルの役割
心不全、心房細動などの病態において、心筋のイオンチャネルが重要な役割を演じているのはよく知られている。我々は、ヒト心臓手術患者の左心耳から心房組織を採取し、各種イオンチャネルの変化につき、詳細に検討している。
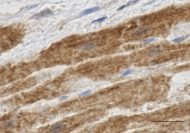
図3 ヒト左心耳におけるTRPA1チャネルの免疫染色
Wavelet変換法を使用した心電図の周波数解析とその臨床応用の研究
心臓の病的remodelingやagingによる線維化の進行などが心電図から推定は可能か
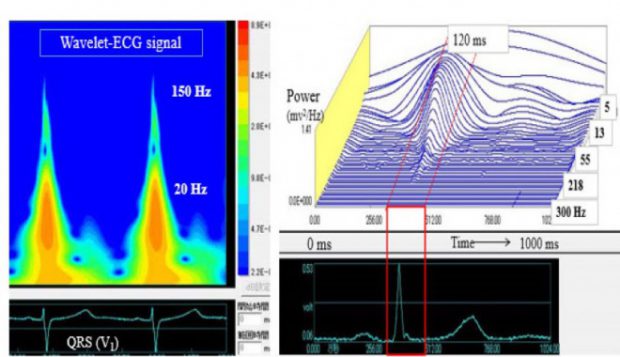
図4 Wavelet変換法を使用した心電図の周波数解析
心電図の主要周波数は5-40 Hzにあり、80 Hz以内で97 %の周波数が表現できるとされている。それ故、心電図機器の周波数特性もJIS規格で0.5-150 Hzの記録ができる機器が推奨されている。一方、傷害心筋では150-250 Hzの高周波が検出されることが1950年代に指摘されたが、適切な解析法や定量法がなく長い間心電図解析のmysterious subjectとされていた。そこで、新しい周波数解析法であるWavelet変換を心電図の周波数解析に応用することを計画、解析ソフトや定量法の開発を進めている。従来の心室遅延電位法はQRSを加算するためQRS終末部の微小電位がターゲットでQRS内部の不整脈原性は記録できない。Wavelet法はSingle beatの解析が可能であるため、致死性心室性不整脈症例の電気的不整脈基質をQRS内部から取り出すことに成功し臨床応用できることを報告している。今後の方向として、QRS内部の高周波は心臓電気現象の発生原である心室壁内微小線維化による興奮波面の破断や小さな伝導異常に由来することが推定される。この仮説を立証する方法の一つとして2-D computer simulation modelを使用し、線維化のレベルと周波数パワーとの関係についての検討を進めている。






