Characterization of a small molecule that promotes cell cycle activation of human induced pluripotent stem cell-derived cardiomyocytes. Ito M, Hara H, Takeda N, Naito AT, Nomura S, Kondo M, Hata Y, Uchiyama M, Morita H, Komuro I. J Mol Cell Cardiol. 2019 Mar;128:90-95.
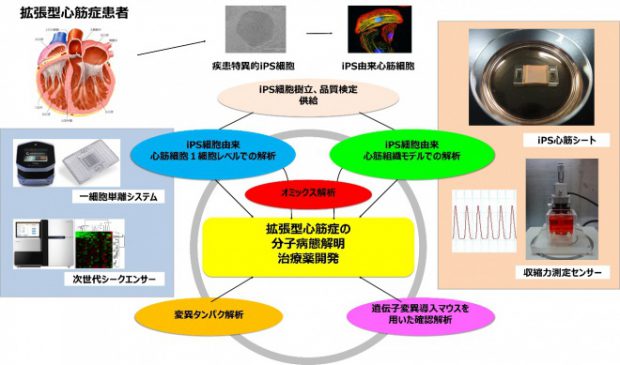
Cardiomyopathy with LMNA Mutation. Ito M, Nomura S. Int Heart J. 2018;59(3):462-464.
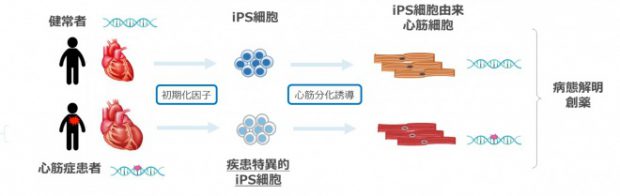
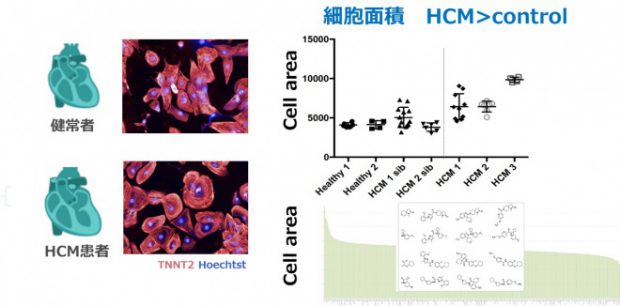
Phenotypic Screening Using Patient-Derived Induced Pluripotent Stem Cells Identified Pyr3 as a Candidate Compound for the Treatment of Infantile Hypertrophic Cardiomyopathy. Sakai T, Naito AT, Kuramoto Y, Ito M, Okada K, Higo T, Nakagawa A, Shibamoto M, Yamaguchi T, Sumida T, Nomura S, Umezawa A, Miyagawa S, Sawa Y, Morita H, Lee JK, Shiojima I, Sakata Y, Komuro I. Int Heart J. 2018 Sep 26;59(5):1096-1105
Generation of Fabry cardiomyopathy model for drug screening using induced pluripotent stem cell-derived cardiomyocytes from a female Fabry patient. Kuramoto Y, Naito AT, Tojo H, Sakai T, Ito M, Shibamoto M, Nakagawa A, Higo T, Okada K, Yamaguchi T, Lee JK, Miyagawa S, Sawa Y, Sakata Y, Komuro I. J Mol Cell Cardiol. 2018 Aug;121:256-265.
Generation of Induced Pluripotent Stem Cells From Patients With Duchenne Muscular Dystrophy and Their Induction to Cardiomyocytes. Hashimoto A, Naito AT, Lee JK, Kitazume-Taneike R, Ito M, Yamaguchi T, Nakata R, Sumida T, Okada K, Nakagawa A, Higo T, Kuramoto Y, Sakai T, Tominaga K, Okinaga T, Kogaki S, Ozono K, Miyagawa S, Sawa Y, Sakata Y, Morita H, Umezawa A, Komuro I. Int Heart J. 2016;57(1):112-7