研究内容
当研究グループでは様々な病態モデル動物を用いて、病態生理学的および分子生物学的アプローチによる詳細な解析を通して心不全の病態解明を目指すとともに、新規心不全治療法の開発につながるシーズの探索を行うBasic to Translational 研究を展開している。
心不全は加齢とともに発症頻度が増加するため、超高齢化社会に突入した日本においては、心不全患者数が爆発的に増加する“心不全パンデミック”の到来は避けがたい状況となっている。約5兆円もの医療費を費やしている心疾患治療において、今後のさらなる心不全医療費の増加は医療経済の崩壊につながりかねない。こうした背景から、心不全克服のための新たな予防・治療法の開発に対する社会的ニーズは過去にないほどに高まっている。
心不全はあらゆる心疾患の終末像といえる。心疾患の発症原因は、生活習慣、遺伝子異常、加齢性変化、内分泌ホルモン動態の変動など実に多様であるが、これまでの心不全治療法は、心不全といういわば“雑多な”病態を標的として開発されたものが多い。従って、個々の心疾患の発症メカニズムを解明するという視点からのアプローチは、新たな心不全予防・治療法の開発へのブレイクスルーとなり得るものとして期待される。
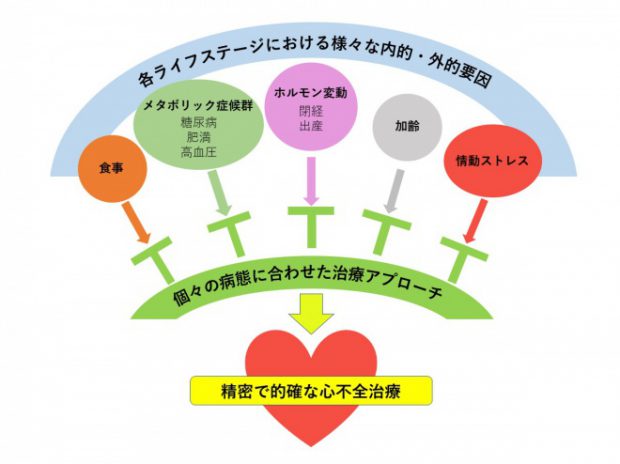
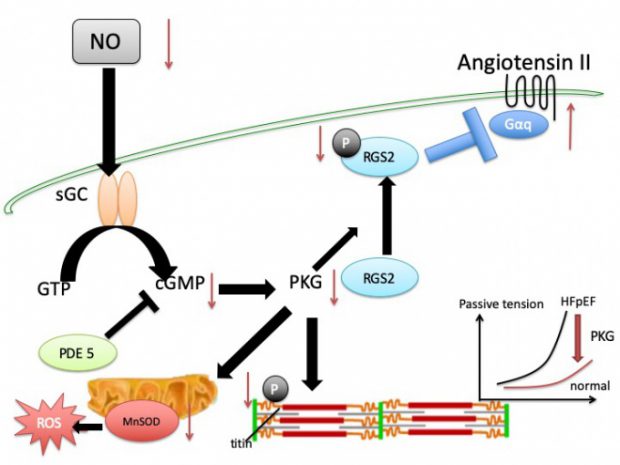
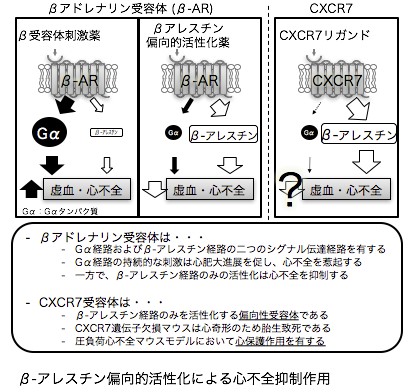
当研究グループでは、以下に示すように、食事による心筋代謝の変動、糖尿病・肥満などの代謝異常、性差(特に閉経後や周産期女性に生じるホルモン変動)、老化といった様々な外的・内的因子が心臓に与える影響を、各種病態モデルマウスを用いて解析している(図1)。また、心臓における各種シグナル伝達経路(cGMP-PKGシグナル経路、βアドレナリン受容体シグナル経路、新規のGタンパク質共役受容体(GPCR)シグナル経路など)にも着目し、心不全発症の分子メカニズムの解明を目指した研究を行っている(図2, 3)。
近年では、“Precision Medicine(精密医療)”や“Personalized Medicine(個別化医療)”という概念が注目されている。我々は基礎研究を通して、心不全患者個々の病態に合わせたより精密で的確な心不全の予防・治療法を開発することで社会に貢献したいと考えている。